Klinikiniais tyrimais įrodyta, kad Kesimpta (ofatumumabas) saugumas yra prilyginamas pirmo pasirinkimo peroraliniam vaistiniam preparatui.1,2*
Nepageidaujamas poveikis
Svarbiausios ir dažniausiai pasireiškusios nepageidaujamos reakcijos yra viršutinių kvėpavimo takų infekcijos (39,4 %), sisteminės su injekcija susijusios reakcijos (20,6 %), injekcijos vietos reakcijos (10,9 %) ir šlapimo takų infekcijos (11,9 %).1
- Bendras infekcijų ir sunkių infekcijų dažnis pacientams, gydytiems ofatumumabu, buvo panašus į pacientų, kurie buvo gydomi teriflunomidu.
- Su injekcija susijusių reakcijų dažnis buvo didžiausias po pirmosios injekcijos suleidimo (14,4 %), o vėliau jų dažnis reikšmingai mažėjo (4,4 % – po antrosios injekcijos, < 3 % – po trečiosios injekcijos).
- Su injekcija susijusios reakcijos dažniausiai (99,8 %) buvo nesunkios ar vidutinio sunkumo. Dviem (0,2 %) ofatumumabo vartojusiems IS pacientams nustatyta sunkių su injekcija susijusių reakcijų, tačiau jos nekėlė pavojaus gyvybei.


Santrumpos:
- IS = išsėtinė sklerozė;
- NA = neaktualu;
- IgG = imunoglobulinas G;
- IgM = imunoglobulinas M;
*Lyginant su teriflunomidu
§Teriflunomido grupės pacientams buvo leidžiamas placebas.1
**Vidutinis IgG kiekis išliko referentinėse ribose (16–19 metų pacientams: 5,49-15,84 g/l; > 19 metų pacientams: 7,00-16,00 g/l). Vidutinis IgM kiekis išliko referentinėse ribose (16–19 metų pacientams: 0,23-2,59 g/l; > 19 metų pacientams: 0,40-2,30 g/l).6 tyrimo pradžioje, 4-ąją ir 12-ąją savaitėmis ir po to kas 12 savaičių (Kesimpta, n = 946; teriflunomidas, n = 936).3
†IgG/IgM kiekis kraujo serume buvo vertinamas tyrimo pradžioje, 4-ąją ir 12-ąją savaitėmis ir po to kas 12 savaičių (Kesimpta, n = 946; teriflunomidas, n = 936).3
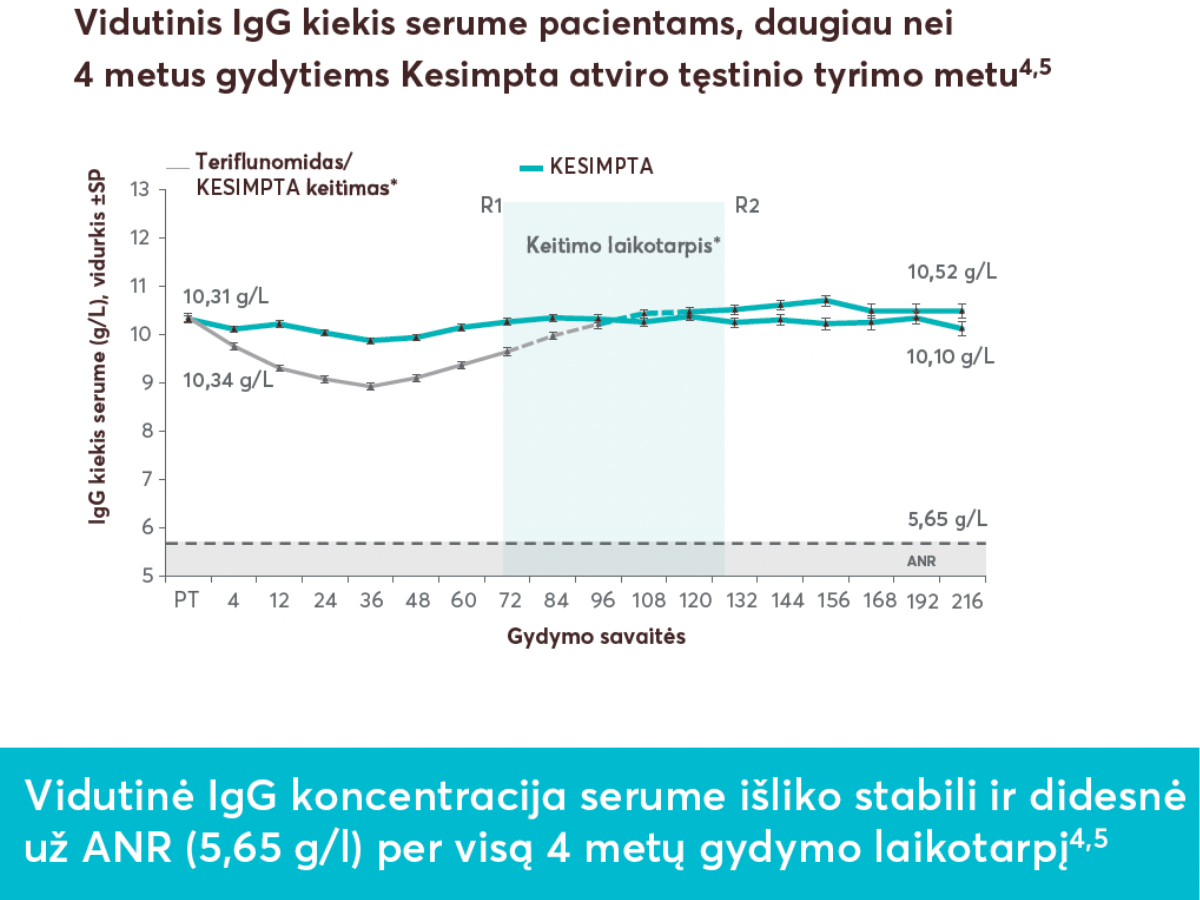
Santrumpos:
- PT = pradinis taškas;
- ANR = apatinė normos riba;
- R1 = pirmas pacientas su gydymo Kesimpta įvertinimu prieš tęsiant Kesimpta (72 savaitės);
- R2 = paskutinis pacientas su gydymo teriflunomidu įvertinimu prieš pradedant vartoti Kesimpta (120 savaičių);
- SP = standartinė paklaida;
- IgG = imunoglobulinas G.
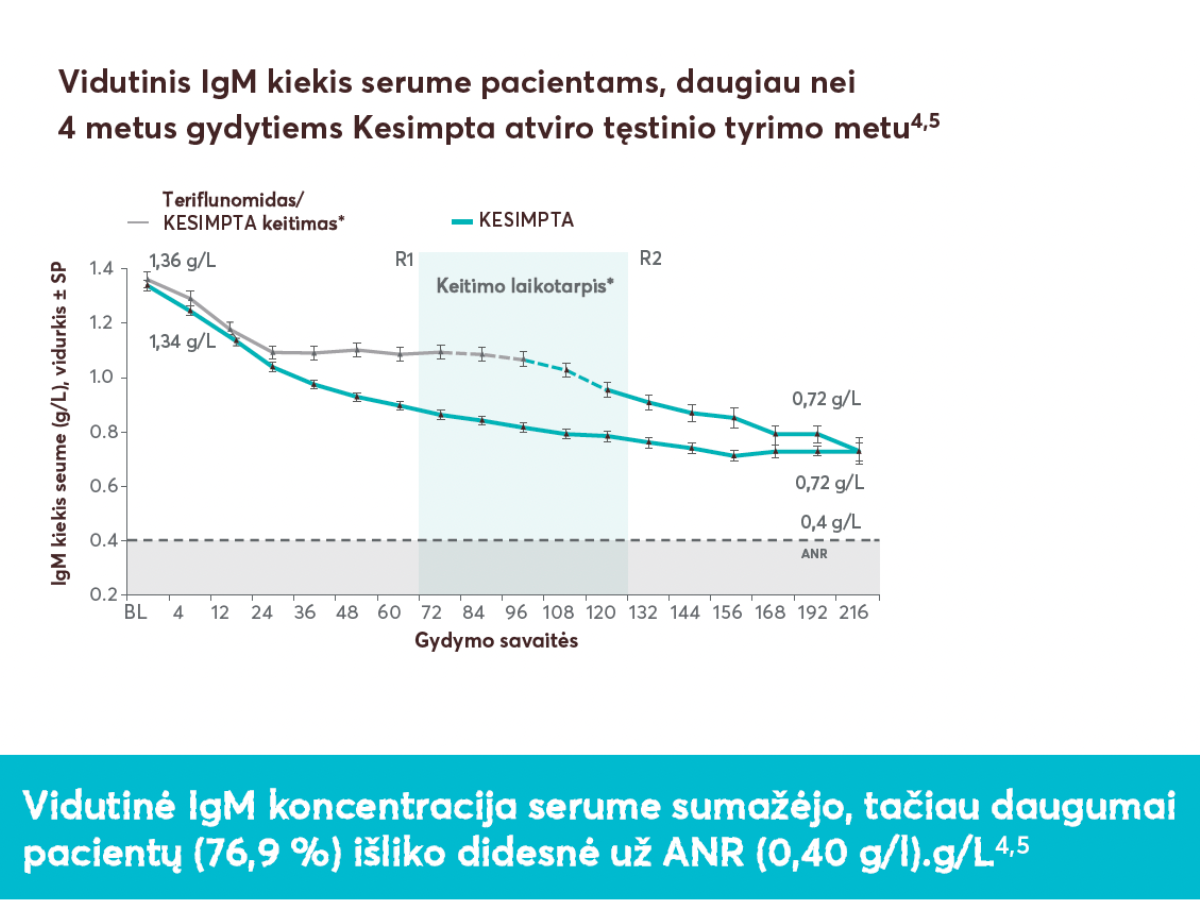
Santrumpos:
- PT = pradinis taškas;
- ANR = apatinė normos riba;
- R1 = pirmas pacientas su gydymo Kesimpta įvertinimu prieš tęsiant Kesimpta (72 savaitės);
- R2 = paskutinis pacientas su gydymo teriflunomidu įvertinimu prieš pradedant vartoti Kesimpta (120 savaičių);
- SP = standartinė paklaida;
- IgM = imunoglobulinas M.
Specialūs įspėjimai ir atsargumo priemonės1
Hepatito B viruso reaktyvacija
- Pacientams, gydytiems anti-CD20 antikūnais, buvo nustatyta hepatito B viruso (HBV) reaktyvacijos atvejų. Pacientams, kurie serga aktyviu hepatitu B, negalima skirti gydymo ofatumumabu.
- Prieš pradedant gydymą visiems pacientams reikia atlikti atrankinius HBV nustatymo tyrimus. Reikia atlikti bent šiuos atrankinius tyrimus: hepatito B paviršiaus antigeno (HBsAg) ir antikūno prieš hepatito B šerdies antigeną (HBcAb) nustatymo tyrimus.
Su injekcija susijusios reakcijos
- Pacientus reikia informuoti, kad su injekcija susijusių reakcijų (sisteminių) paprastai gali pasireikšti per 24 valandas ir dažniausiai po pirmosios injekcijos. Klinikinių tyrimų metu pastebėta tik nedidelė nauda skiriant premedikaciją steroidais.
- Jeigu pasireikštų su injekcija susijusių reakcijų, jas galima palengvinti skiriant simptominį gydymą. Todėl premedikacijos atlikti nereikia.
- Klinikinių tyrimų metu pastebėta tokių injekcijos vietos reakcijų (vietinių) simptomų: eritema, patinimas, niežėjimas ir skausmas.
- Pirmąją injekciją reikia suleisti prižiūrint tinkamai apmokytam sveikatos priežiūros specialistui.
Nėštumas ir šeimos planavimas
- Vaisingo amžiaus moterys turi naudoti veiksmingas kontracepcijos priemones, kadangi duomenų apie ofatumumabo vartojimą nėštumo metu nepakanka.
- Kontracepcijos priemones vartoti dar 6 mėnesius po paskutiniosios Kesimpta dozės vartojimo.
- Ofatumumabo vartojimas moterims žindymo laikotarpiu neištirtas. Nežinoma, ar ofatumumabas išsiskiria į motinos pieną.
Infekcijos
- Prieš pradedant skirti gydymą rekomenduojama įvertinti paciento imuninės sistemos būklę.
- Remiantis veikimo mechanizmu ir turima klinikine patirtimi, ofatumumabo vartojimas gali didinti infekcijų pasireiškimo riziką. Pacientams, kuriems nustatyta aktyvi infekcija, vaistinio preparato skyrimą reikia atidėti, kol jie pasveiks.
- Ofatumumabo negalima skirti tiems pacientams, kuriems stipriai sutrikusi imuninės sistemos veikla (pvz., yra reikšminga neutropenija ar limfopenija).
- John Cunningham (JC) viruso infekcijos. Gydytojai turėtų atidžiai stebėti pacientus, kurie anksčiau sirgo progresuojančiąja daugiažidinine leukoencefalopatija (PDL), o taip pat dėl bet kokių klinikinių simptomų ar MRT pokyčių, kurie galėtų rodyti PDL, pasireiškimo. Jeigu įtariama PDL, gydymą ofatumumabu reikia nutraukti, kol nebus atmesta įtariamos PDL tikimybė.
Pacientų, kuriems stipriai sutrikusi imuninės sistemos veikla, gydymas
- Pacientams, kuriems stipriai sutrikusi imuninės sistemos veikla, negalima skirti gydymo, kol ši jų būklė visiškai neatsistatys.
- Kartu su ofatumumabu nerekomenduojama skirti kitų imunosupresantų, išskyrus ligos paūmėjimų gydymui skiriamus kortikosteroidus.
Vakcinacija
- Skiepyti gyvosiomis ar gyvosiomis susilpnintomis vakcinomis gydymo metu ir po vaistinio preparato vartojimo nutraukimo, kol neatsistatė B ląstelių kiekis, nerekomenduojama. Gyvąsias ar gyvąsias susilpnintas vakcinas skirti likus bent 4 savaitėms iki ofatumumabo vartojimo pradžios.
- Ofatumumabas gali slopinti inaktyvintųjų vakcinų veiksmingumą. Inaktyvintąsias vakcinas skirti likus bent 2 savaitėms iki ofatumumabo vartojimo pradžios.
Kūdikių, kurių motinos nėštumo metu vartojo ofatumumabo, vakcinacija
- Kūdikių, kurių motinos nėštumo metu vartojo ofatumumabo, negalima skiepyti gyvosiomis ar gyvosiomis susilpnintomis vakcinomis, kol nebus patvirtinta, jog atsistatė B ląstelių kiekis. B ląstelių kiekio sumažėjimas šiems kūdikiams gali didinti su skiepijimu gyvosiomis ar gyvosiomis susilpnintomis vakcinomis susijusią riziką.
- Prireikus galima skirti inaktyvintųjų vakcinų iki sumažėjusio B ląstelių kiekio atsistatymo, tačiau reikėtų įvertinti imuninį atsaką į vakcinaciją, įskaitant ir kvalifikuoto specialisto konsultacijos poreikį, siekiant įsitikinti, jog pasireiškė apsauginis imuninis atsakas.
Santrumpos:
- MRT = magnetinio rezonanso tyrimas,
Literatūros sąrašas:
- Kesimpta preparato charakteristikų santrauka 2023-02-09.
- Hauser SL, Bar-Or A, Cohen J, et al. Efficacy and safety of ofatumumab versus teriflunomide in RMS: Phase 3 ASCLEPIOS I and II trials. Presented at: 25th Congress of the European Committee for Treatment and Research in Multiple Sclerosis; 11-13 September, 2019; Stockholm, Sweden.
- de Seze J, Bar-Or A, Correale J, et al. Effect of ofatumumab on serum immunoglobulin levels and infection risk in relapsing multiple sclerosis patients from the phase 3 ASCLEPIOS I and II trials. Paper presented at: American Academy of Neurology; 25 April-1 May, 2020; Toronto, Canada.
- Hauser SL, Cross AH, Winthrop K, et al. Long-term safety of ofatumumab in patients with relapsing multiple sclerosis. Posterpresented at: American Academy of Neurology (AAN), 2022, 2-7 April 2022; Seattle, WA, USA.
- Hauser SL, Cross AH, WinthropK, et al. Safety experience with continued exposure to ofatumumab in patients with relapsing forms of multiple sclerosis for up to 3.5 years. Mult Scler. 2022;28(10):1576-1590.
